爬行动物中由单细胞转录组揭示的大脑皮层,海马和皮层细胞类型的进化
这是读的第一篇的关于不同物种脑比较的文章,进行了较为精细的阅读,故作此记录。原文链接
摘要
哺乳动物皮层中的计算通过谷氨酸和γ氨基丁酸释放神经元形成的特定回路区域进行的。我们在这里探究了这些神经元,这些区域是如何在羊膜动物中进化的。我们使用了大规模的单细胞 mRNA 测序构建了两种爬行动物的大脑皮层的基因表达图谱。爬行动物皮层中谷氨酸神经元转录特征表明哺乳动物新皮质层是由新的细胞类型通过祖先的基因调控程序分化生成的。相反的,爬行动物的 GABAergic 神经元的分化表明在哺乳动物中已知的中间神经元类型早已存在于羊膜动物的共同祖先中。
开篇
大约3.2亿年前,羊膜类脊椎动物(哺乳动物、爬行动物和鸟类)起源于一个共同的祖先。在所有发育中的羊膜动物中,端脑背侧(dorsal telencephalon)或大脑皮层有着相同的信号分子,并被分为同源的胚胎区域。然而在成年羊膜动物脑区中,来自这些同源皮层区域的结构具有不同的形态和连接性。例如,六层大脑皮层只存在于哺乳动物中,背侧脑室脊(DVR)只在鸟类和爬行动物中发现。海马区可能是最保守的大脑皮层区域,即使在海马区,也不确定哺乳动物中已知的所有亚区(例如齿状回),是否在非哺乳动物中也存在。
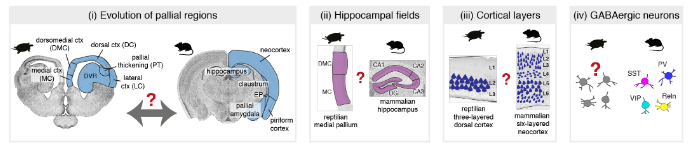
基因表达数据可以帮助重建大脑区域和细胞类型的进化。在这里,我们使用单细胞转录组学来研究羊膜动物脑中神经元多样性的进化。因为通过转录组学定义的细胞类型与通过形态学、生理学和连接性定义的细胞类型相匹配,单细胞mRNA测序不仅可以用于细胞类型发现和还可以用于跨物种比较。爬行动物不同于鸟类,有分层的大脑皮层,本文聚焦于爬行动物,并提出了以下问题:(1)我们是否能够识别爬行动物和哺乳动物大脑皮层区域之间的分子相似性和同源性?(2)是否存在与哺乳动物海马神经元同源的哺乳动物皮层神经元?(3)我们能把爬行动物的三层cortex和哺乳动物的六层 neocortex 联系起来吗?(4)哺乳动物释放γ-氨基丁酸的中间神经元类型是否也存在于爬行动物大脑皮层中。
爬行动物大脑皮层的神经元和神经胶质细胞
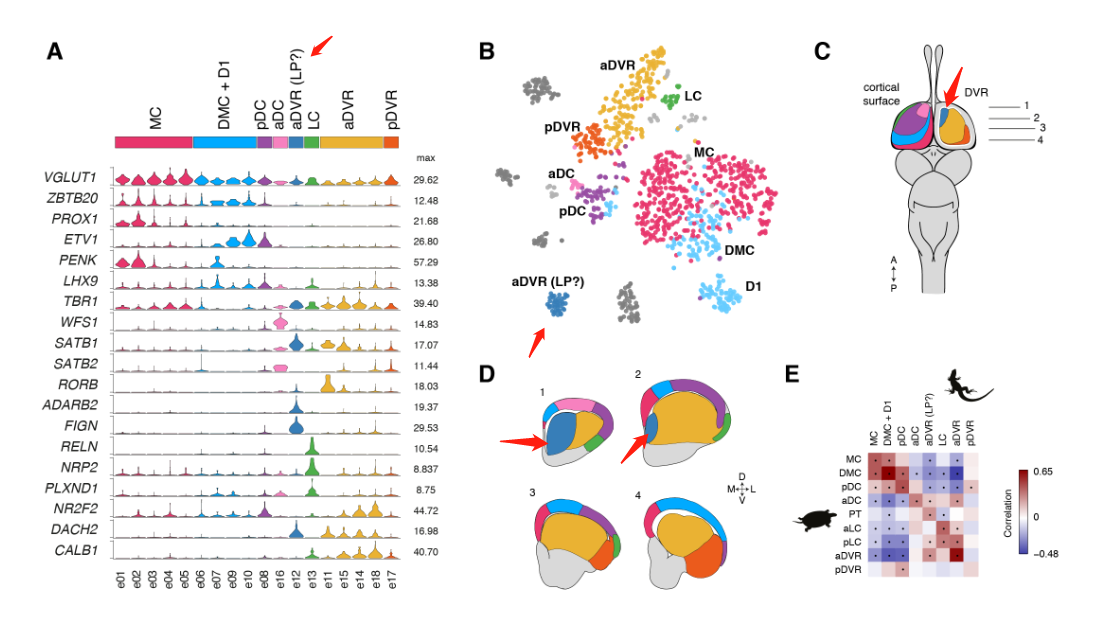
使用Drop-seq,我们获得了从海龟和蜥蜴物种的大脑皮层取样的成体细胞类型的全面、无偏见的分类(在图S1和S2以及表S1和S2中的解剖和测序统计)。
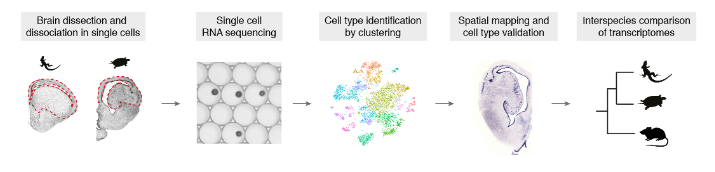
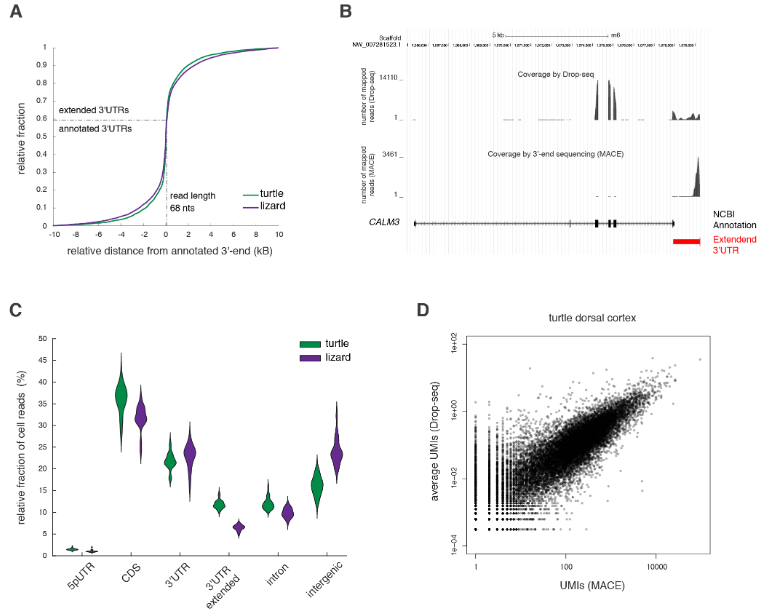
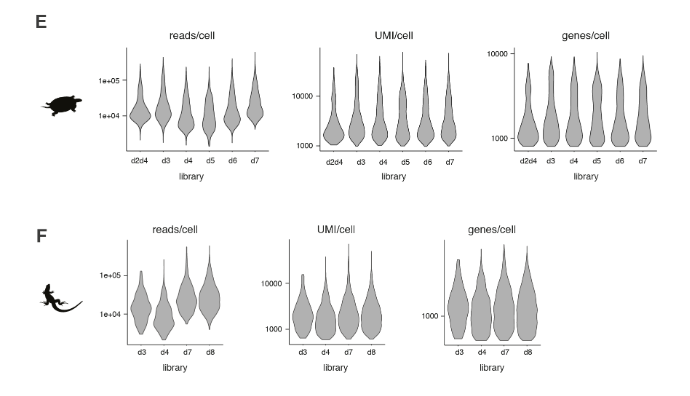
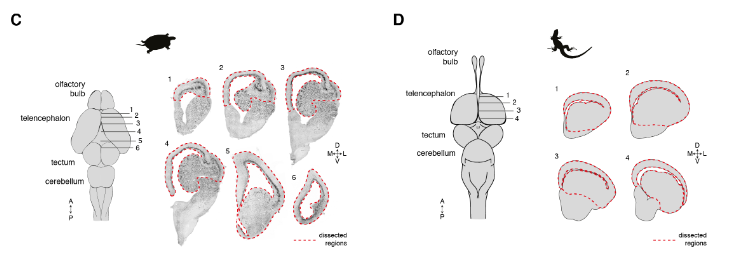
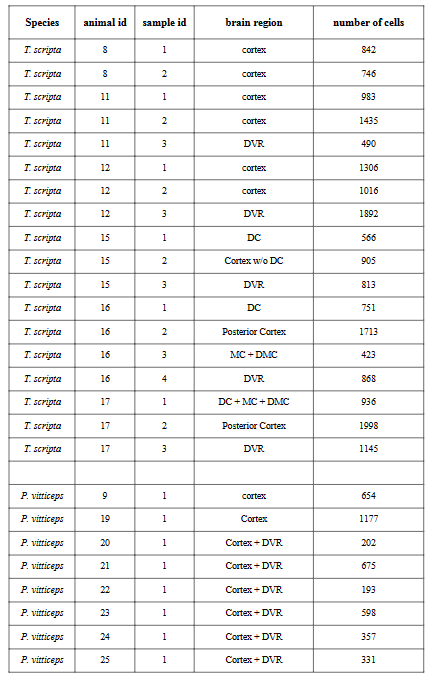
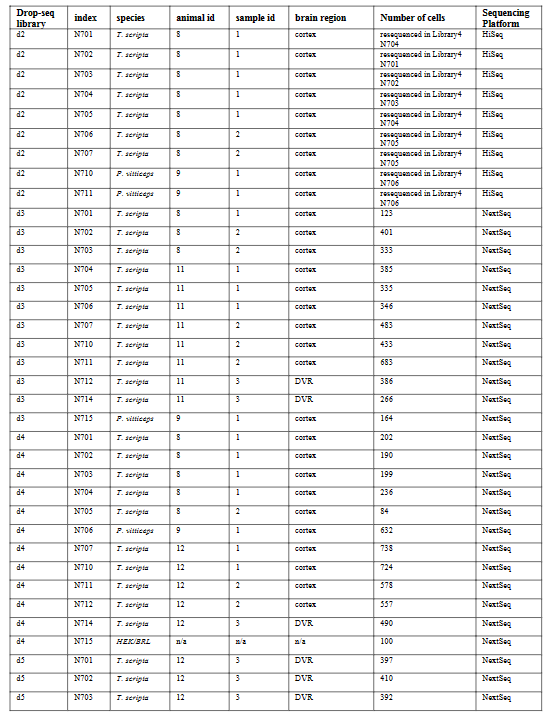
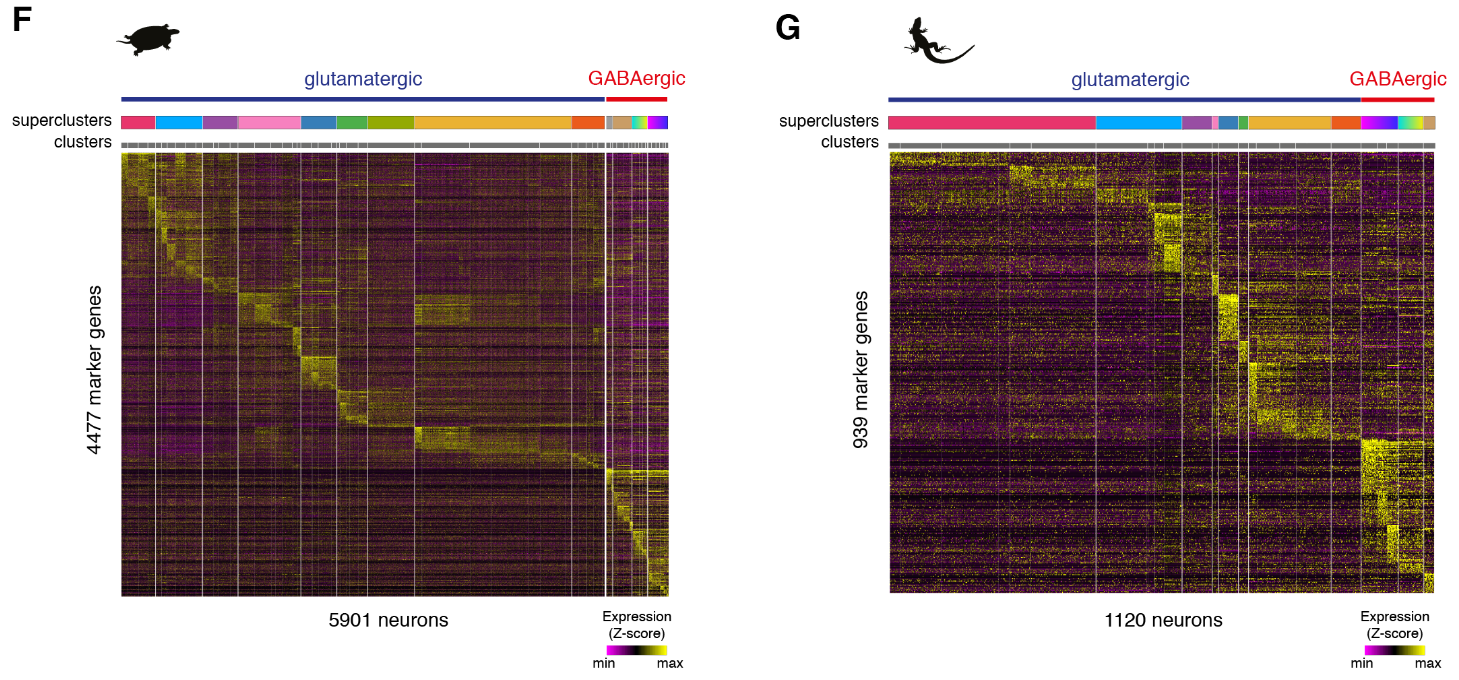
在质量过滤后,我们使用了来自18,828只海龟和4187只蜥蜴细胞的转录物的无监督的基于图的聚类(每个细胞的中值分别为2731.5和1918个转录物),并鉴定了神经元和非神经元细胞的一级聚类。
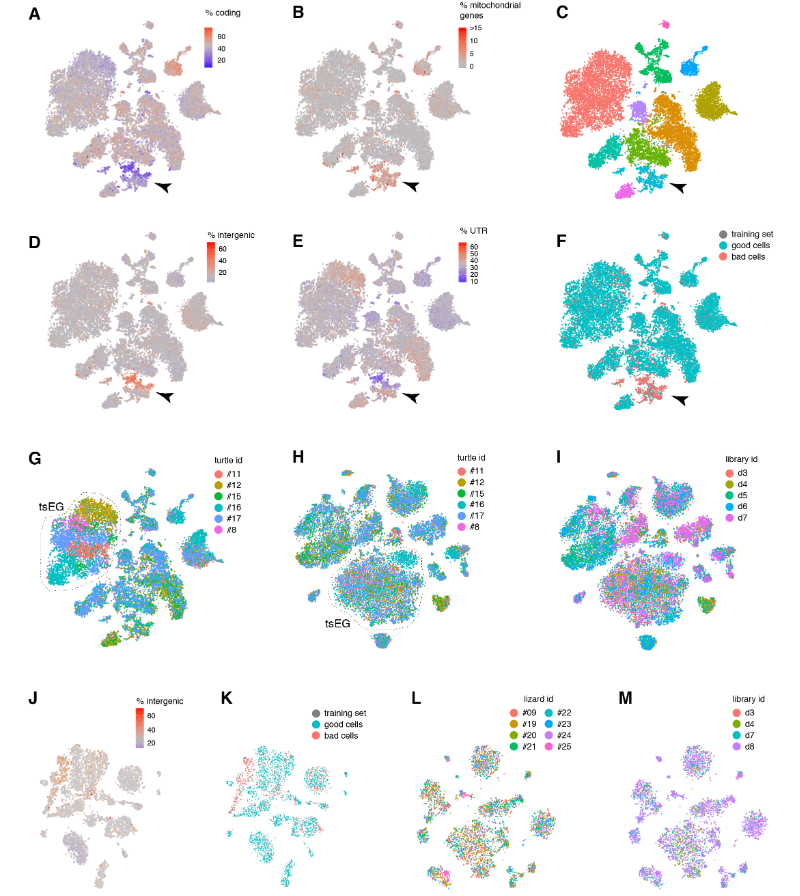
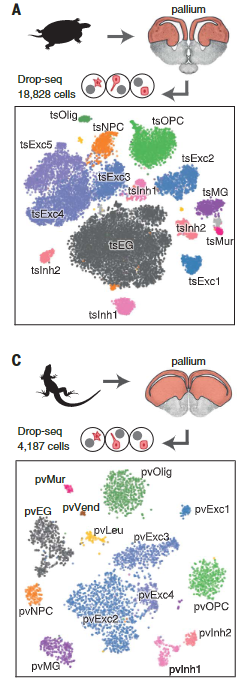
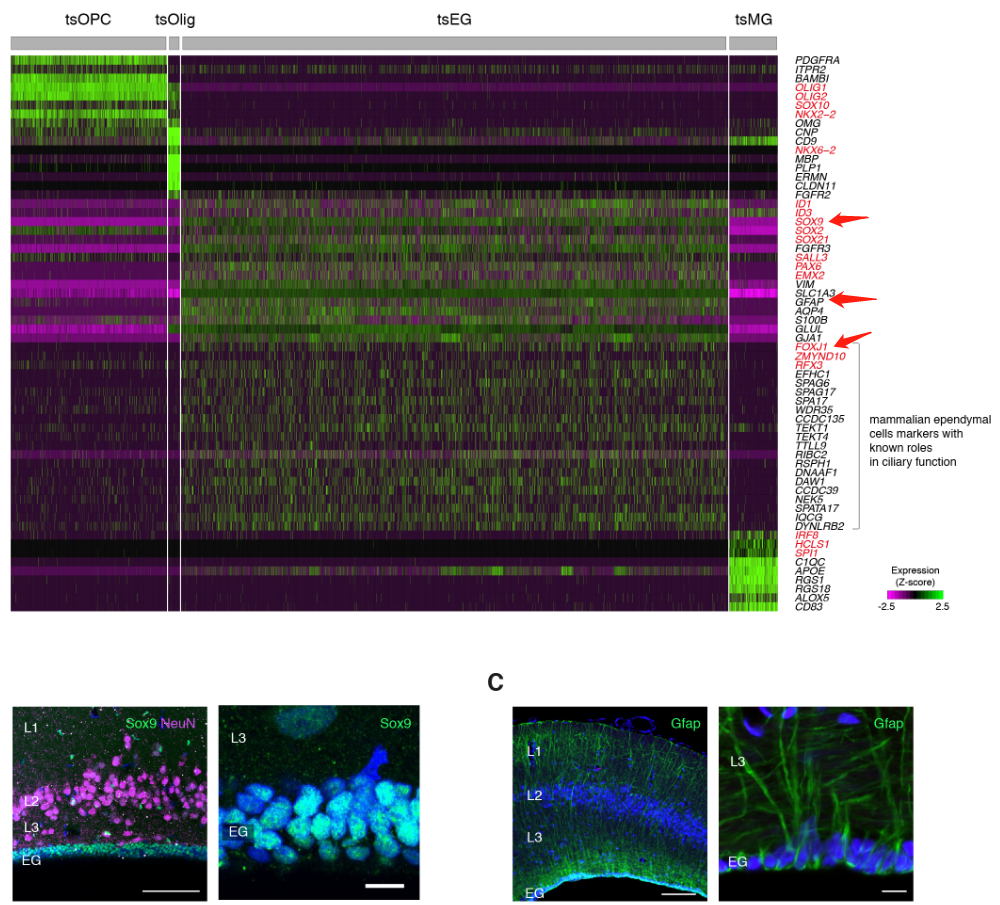
在非神经元细胞中,我们发现了表达哺乳动物神经胶质细胞原型标记物的簇:成熟少突胶质细胞及其前体、室管膜胶质细胞和小胶质细胞。
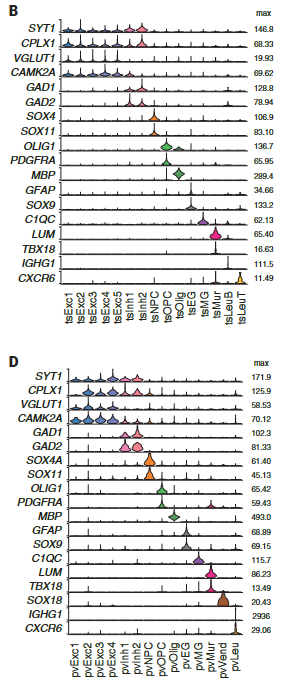
哺乳动物星形胶质细胞室管膜胶质细胞共表达(GFAP)、成体干细胞(SOX9)和室管膜细胞(FOXJ1)的标记,表明这些细胞类型具有共同的进化起源(图S4,A至C)。
爬行动物神经元簇包括囊泡谷氨酸转运体1型(VGLUT1+),谷氨酸能兴奋性神经元、谷氨酸脱羧酶1和2(gaD1 + gaD2+),γ-氨基丁酸能抑制性中间神经元和神经祖细胞(图1,A至D),与爬行动物成体神经发生的存在一致。
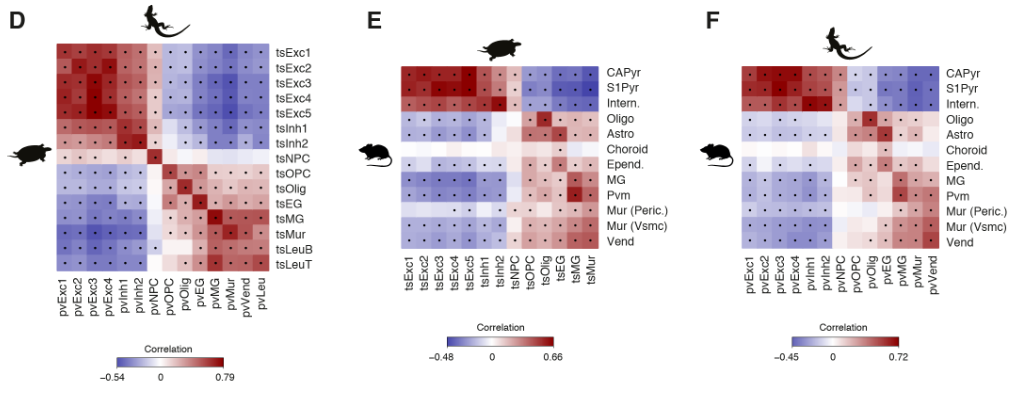
为了比较海龟、蜥蜴和小鼠神经元和非神经元细胞的转录组,我们选择了在这些细胞类型中差异表达的一对一的同源物,定义了每个簇中每个基因的特异性得分,并计算了成对的秩相关关系。该分析支持海龟、蜥蜴和小鼠的主要神经元和非神经元细胞类别之间的一致性。
乌龟和蜥蜴神经元的亚聚类揭示了兴奋性谷氨酸能和抑制性γ-氨基丁酸能神经元类型之间和之内的更细微的区别。
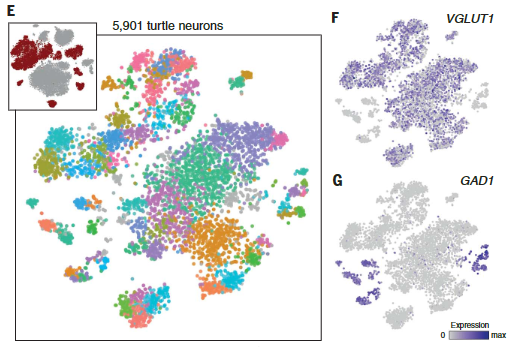
从这些神经元数据集中,我们选择差异表达的基因作为组织学验证和与哺乳动物细胞类型进行无偏比较的标记。我们专注于海龟的数据,并用蜥蜴的数据来佐证。
谷氨酸能神经元的空间分离:爬行动物大脑皮层的分子图谱
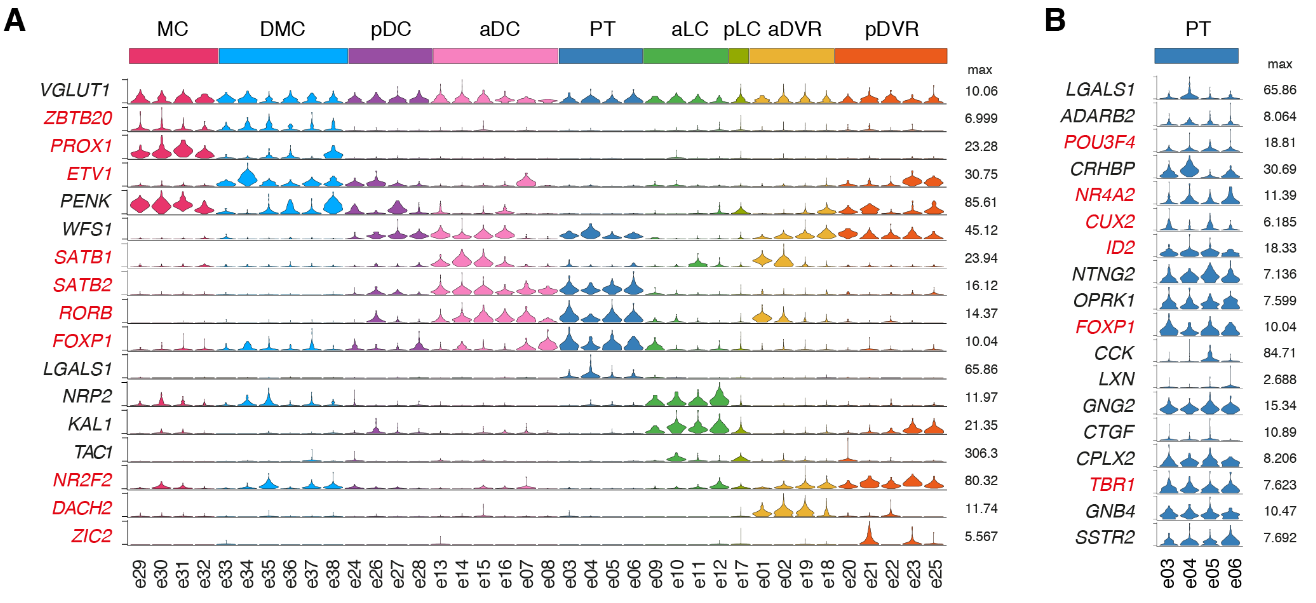
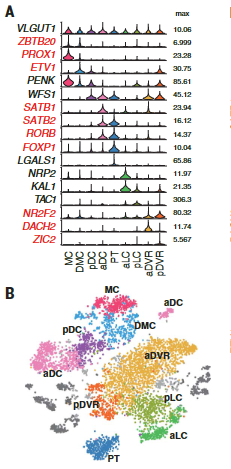
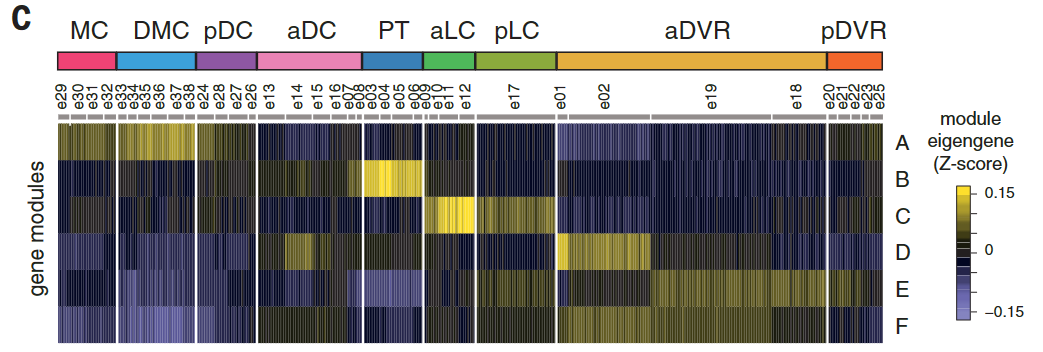
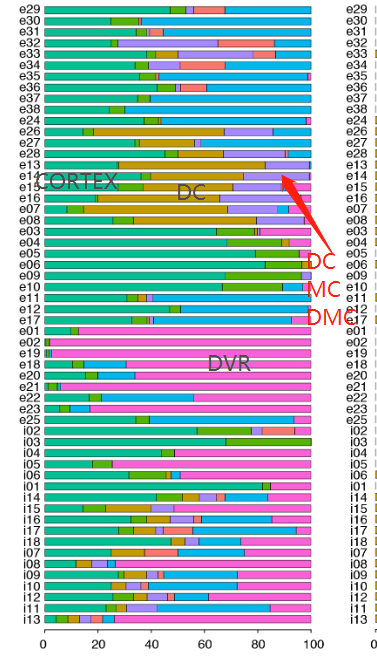
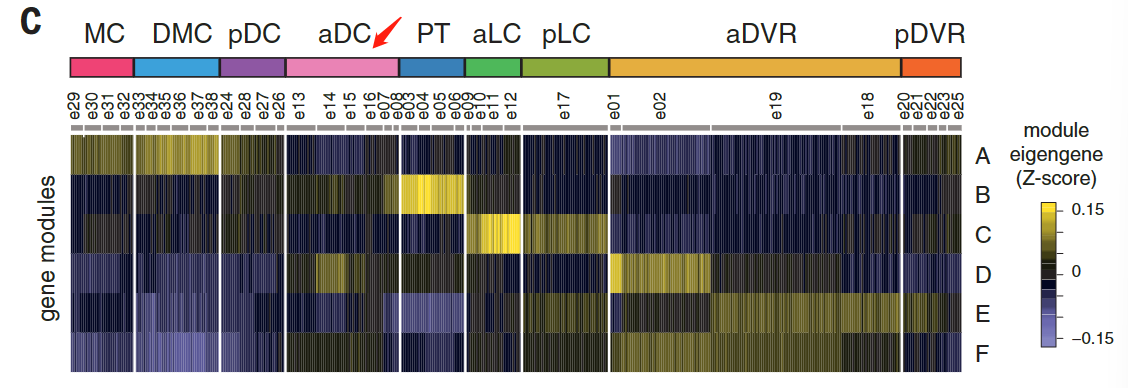
我们的解剖涵盖了爬行动物大脑皮层的多个区域,这些区域可能包含不同种类的谷氨酸能神经元。为了确定我们的海龟谷氨酸能细胞簇的解剖位置,我们在数据集中选择了高度可变的基因,这些基因在一些簇中表达,但在另一些簇中没有检测到。这些标记在大脑皮层的不同区域表达。
标记的组合表达被定义为“超簇”,也被视为t分布随机相邻嵌入(tSNE)图中相邻簇的分组(图2,A至B,和图S6A比较图1E和图2B),
与更高级聚类分析和我们的组织切片一致(图S7和S8D以及表S1和S2)。
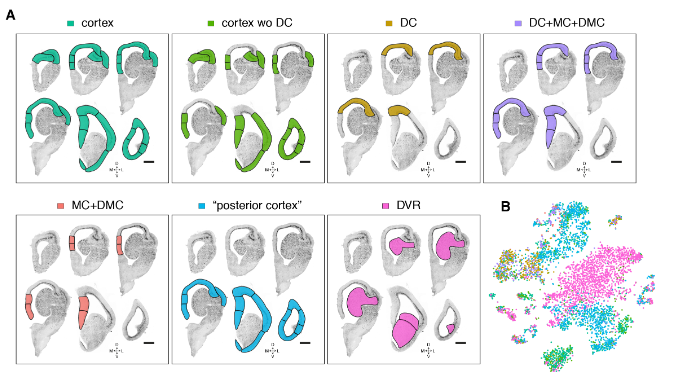
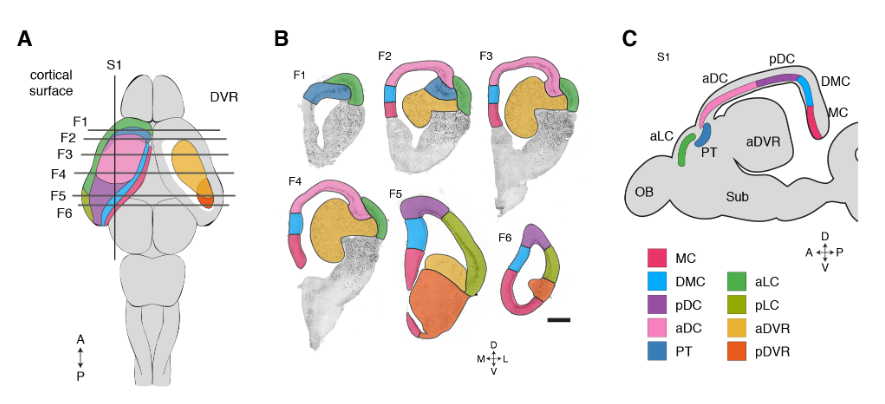
这些超簇对应于定义的解剖区域:内侧皮层(medial cortex),背内侧皮层(dorsal medial cortex)、前背侧皮层(anterior dorsal cortex)和后背侧皮层(posterior dorsal cortex)、大脑皮层增厚区(the pallial thickending)、前外侧皮层(anterior lateral cortex)和后外侧皮层(posterior lateral cortex)以及前DVR(anterior DVR)和后DVR(posterior DVR)。
簇内细胞类型的相关性大于簇之间的细胞类型相关性。
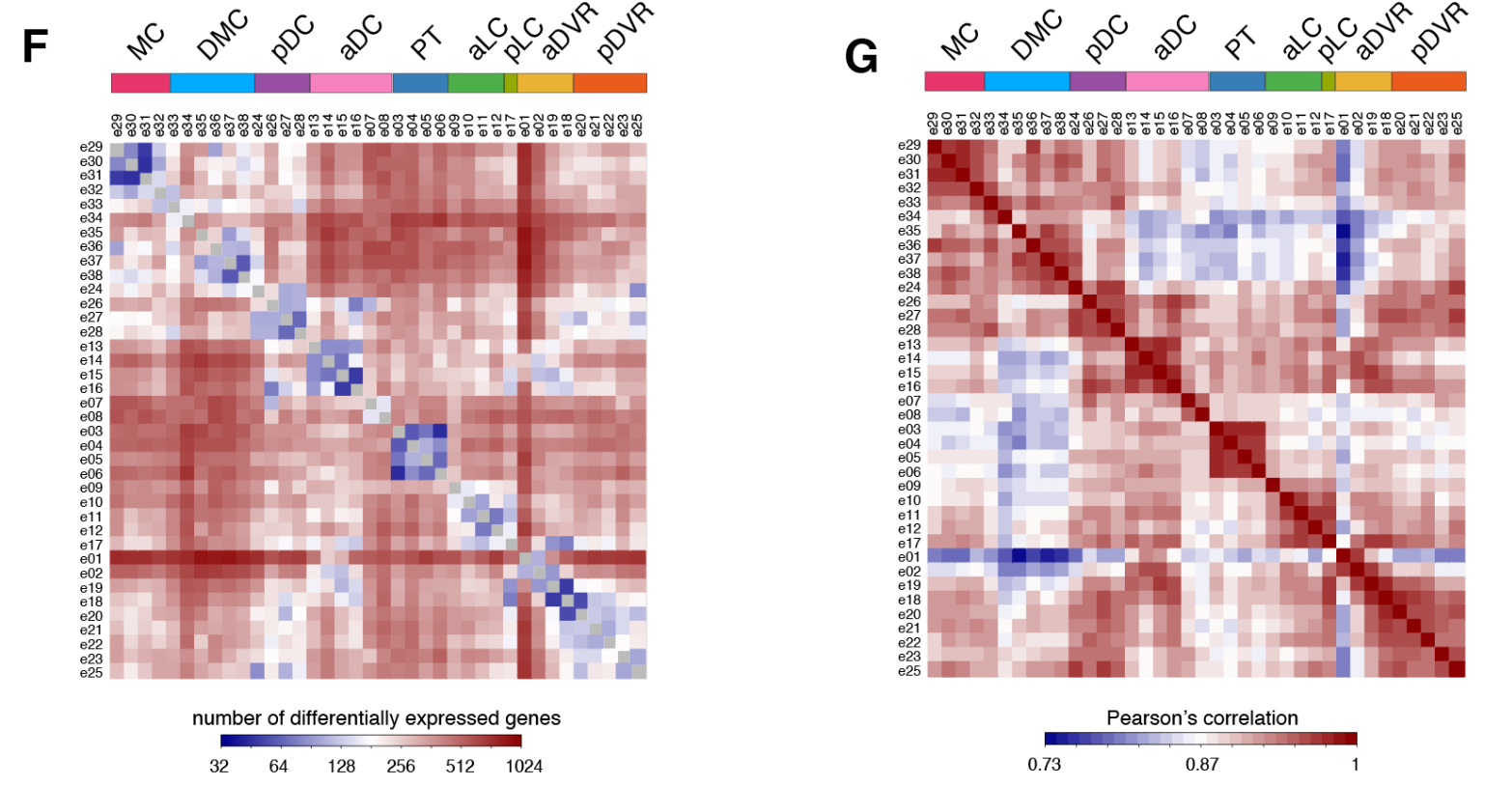
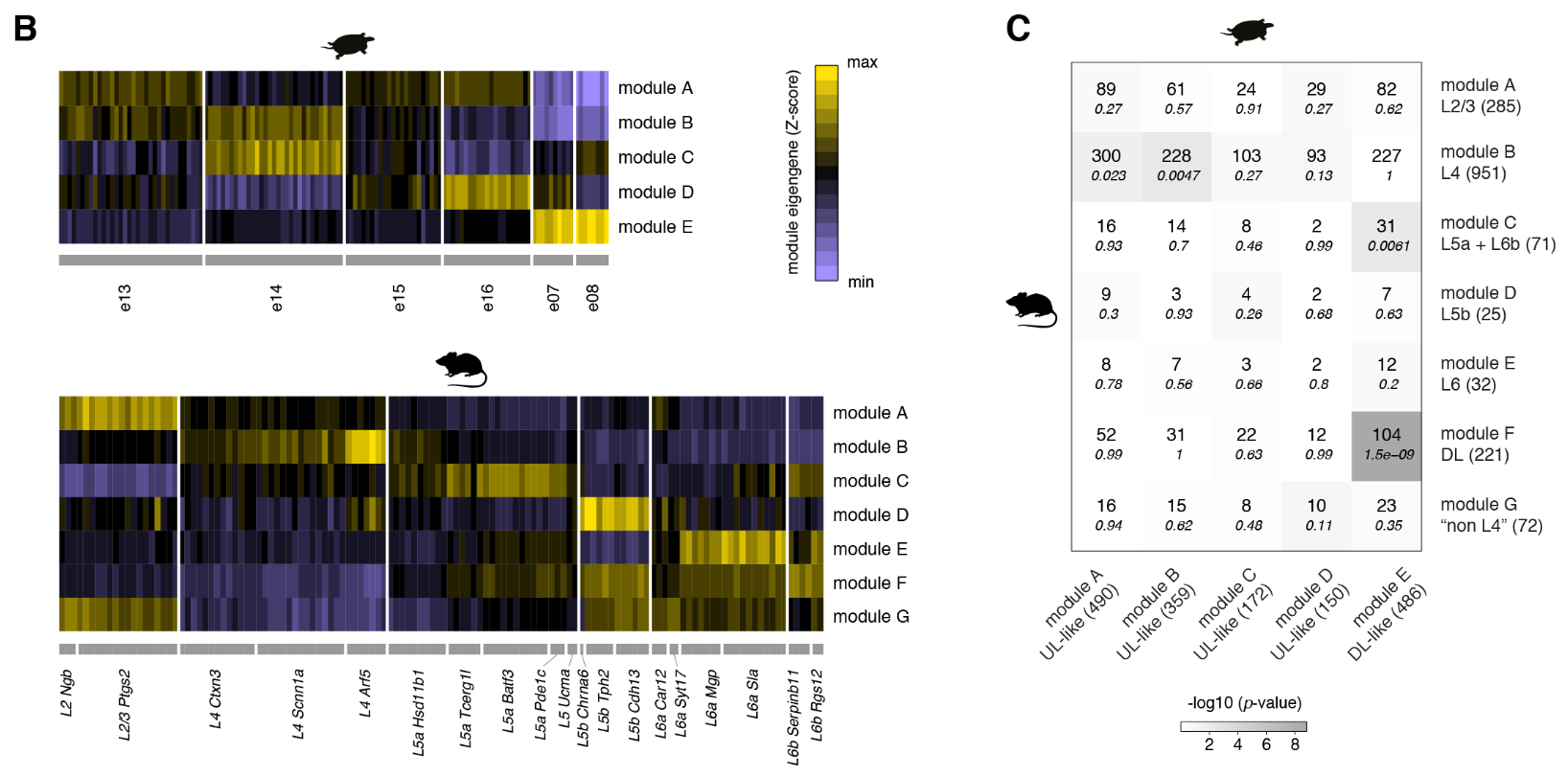
加权基因相关网络分析(WGCNA,见方法)表明每个区域的独特基因特征来自基因模块的不同组合(图2C)。
我们还将谷氨酸能簇与蜥蜴的解剖学定义的大脑皮层区域相关联(图S9)。
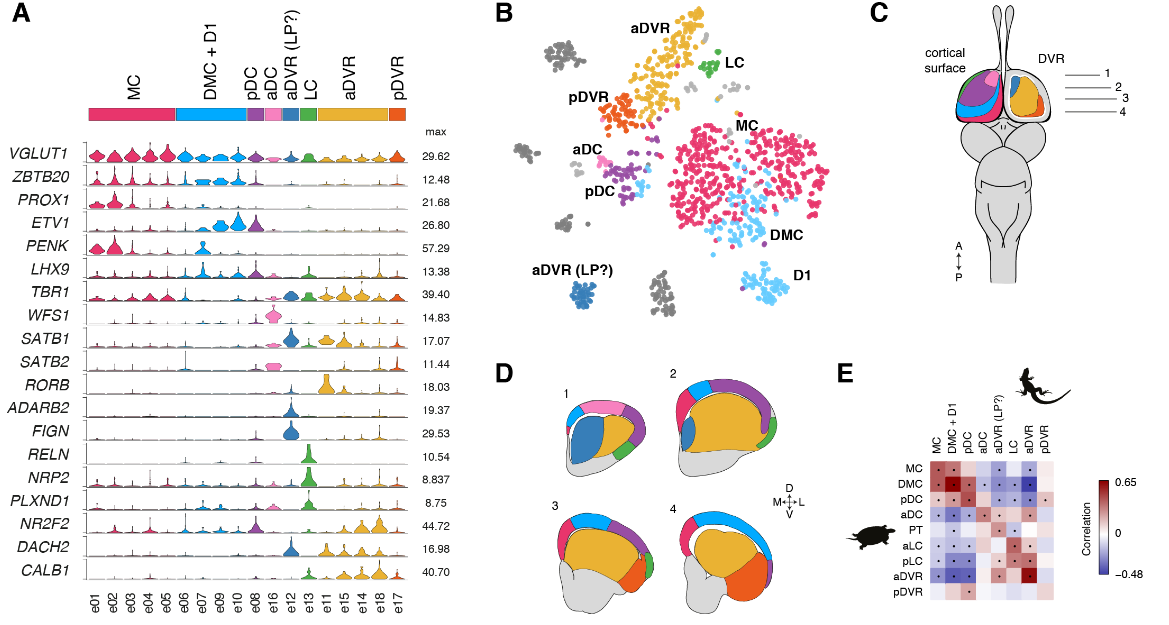
蜥蜴和海龟中的相应区域具有不同的相对大小(例如,蜥蜴前背皮层较小),但通过表达相同的发育转录因子如ZBTB20、SATB1、DACH2和ETV1 (ER81)而清晰地描绘出来(图 2D)。这些数据确定了成年爬行动物大脑皮层的分子分区。
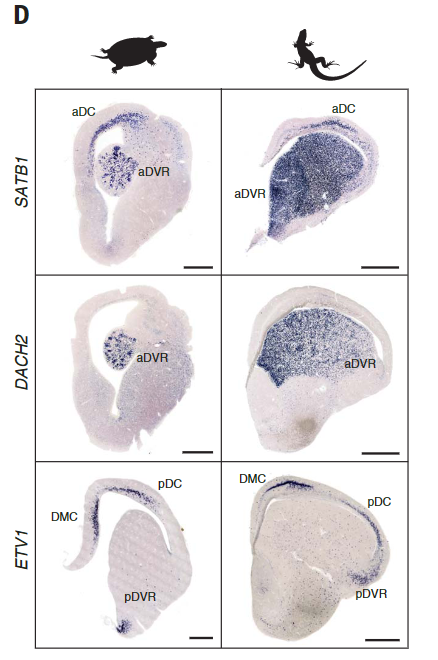
在龟和蜥蜴中标记相应大脑皮层区域的转录因子的表达。
爬行动物和哺乳动物大脑皮层衍生物之间的假定同源性是有争议的。这场争论的中心是前DVR,它是鸟类和爬行动物腹侧大脑皮层的衍生物之一。该区域被认为是哺乳动物腹侧大脑皮层衍生物(皮层、内环形核和杏仁体)或大脑皮层部分的同源物。后一种假设表明了新皮层的双重进化起源,要么是单独的区域——内侧和外侧新皮层分别与爬行动物背侧皮层和DVR同源——要么是混合的细胞类型,其中单独的新皮层与爬行动物背侧皮层或DVR同源。我们使用了一个人类微型芯片数据集作为参考,将海龟超簇于哺乳类大脑皮层衍生物做了比较。我们的分析使用了所有的差异表达基因。
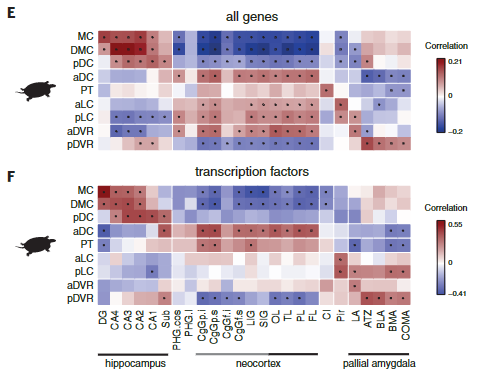
揭示了内侧和背内侧皮层于人类海马体的相似性,支持了先前的假设。在哺乳动物中,前背侧皮层和前DVR区在转录因子表达上的不同,发现在新皮层和大脑皮层杏仁核也是这样。
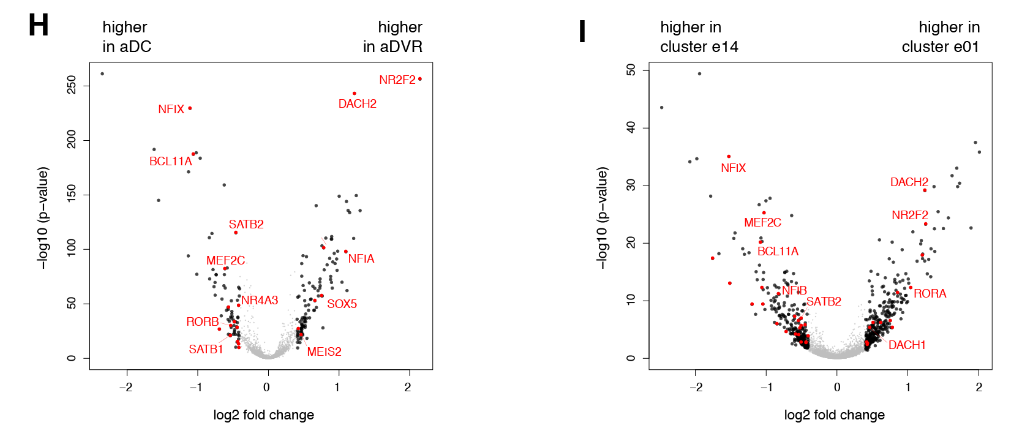
在哺乳动物大脑皮层杏仁核子分区中,只有侧杏仁核和前DVR区相关。我们的结果表明:(1)转录因子的不同组合可能调节前背皮层和前DVR中“新皮层”效应基因的表达;( 2)转录因子的表达反映了大脑皮层神经元的发育和进化历史。由此可以进一步提出,爬行动物前背皮层和哺乳动物新皮层作为背侧大脑皮层衍生物是同源的,爬行动物DVR和哺乳动物大脑皮层杏仁核作为腹侧大脑皮层衍生物是同源的。在爬行动物中,感觉受体前DVR的扩张导致了专门处理不同感觉形式的神经元类型的出现,可识别为独立的分子、解剖和功能簇(图S9和S10) (17)。
根据这一假说,爬行动物的前DVR和哺乳动物的新大脑皮层通过趋同进化获得了相似的效应基因表达。
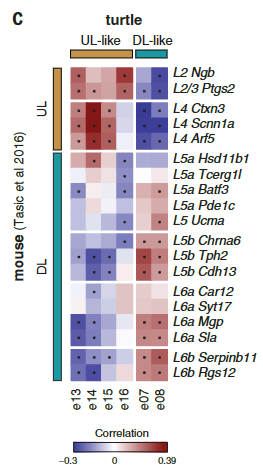
海马神经元类型和区域组织的保守性
解剖学和发育的证据表明爬行动物的最内侧皮层与哺乳动物的海马是同源的。与此相似,乌龟和蜥蜴的内侧皮层表达哺乳动物泛海马转录因子ZBTB20(图3A和图S11)。
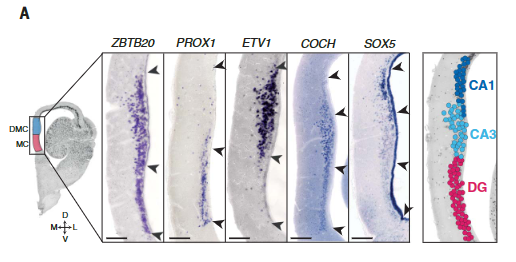
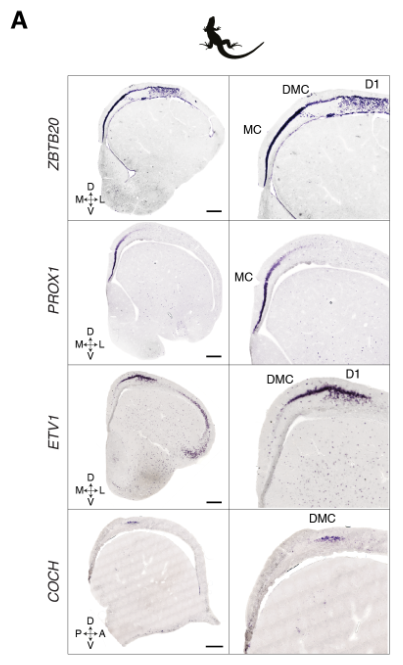
爬行动物和鸟类中是否存在单独的海马亚区[齿状回(DG)、海马角(CA)3、CA2和CA1]尚不清楚。发育证据表明一些人将哺乳动物DG及其苔藓细胞和颗粒细胞描述为哺乳动物的新的东西。爬行动物ZBTB20阳性簇可通过哺乳动物DG或CA转录因子的表达进一步区分:在龟中,PROX1和MEF2C(指定小鼠DG颗粒细胞)标记内侧皮层,ETV1、MEIS2和LMO4 (CA)标记背内侧皮层(图3A)。
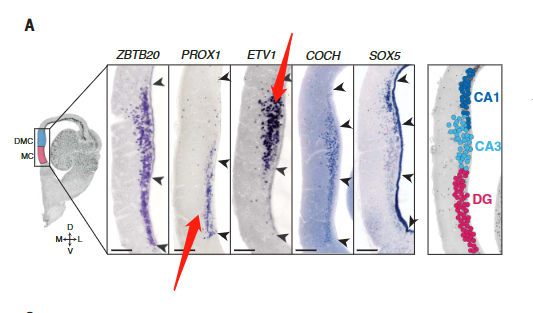
这些基因在龟和蜥蜴中皮层相邻区域的表达(图S11)表明爬行动物中存在DG-和CA-样神经元类型。细胞型转录组的无偏分析进一步支持了这一观点。
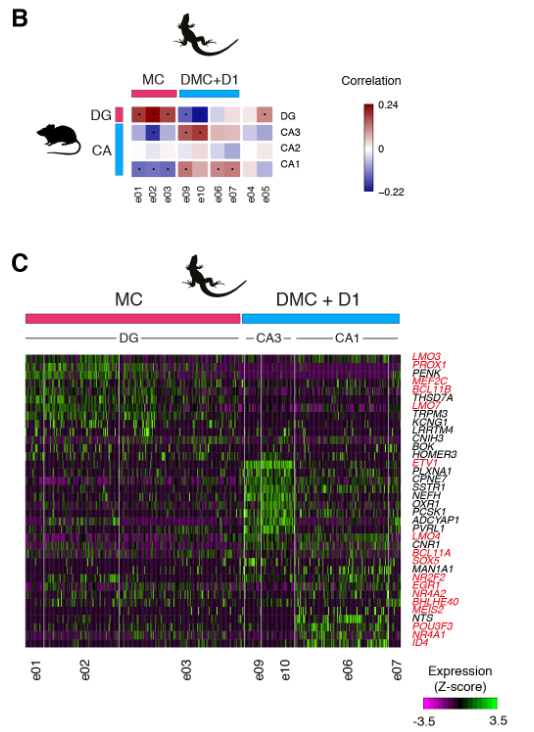
使用WGCNA来鉴定和比较基因模块,我们发现小鼠DG和海龟内侧皮层模块之间以及小鼠CA和龟背内侧皮质模块之间有统计学上显著的重叠(图S12)。
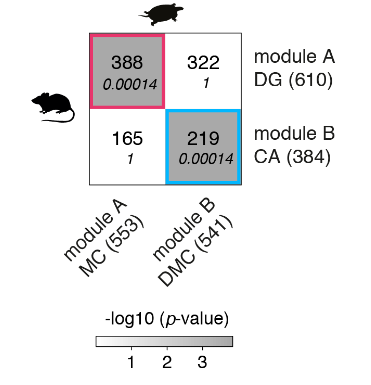
海龟(列)和小鼠(行)海马基因模块的重叠。该表显示了重叠基因的数量和重叠的p值(斜体)。括号中为每个模块中的基因数。
小鼠DG和海龟内侧皮层模块共享编码K例子通道亚单位或相关蛋白(KCNG1、KCNA1和KCNIP4)的基因,这可能是电生理学相似性的原因。其他共享基因包括参与DG-CA3突触形成的钙粘蛋白CDH8,以及突触发生的颗粒细胞特异性调节因子和AMPA受体介导的突触传递LRRTM4和CNIH3(图S12)。

海龟和老鼠基因网络结合的图解。节点代表基因,根据(C)进行颜色编码;连线代表基因与基因之间的相关性。
因此,DG颗粒细胞,包括其膜和突触生理学方面,在哺乳动物和爬行动物中是保守的。[没有苔藓细胞标记物(21)在海龟内侧皮质中具有细胞类型特异性表达。]
接下来,我们使用在ZBTB20+簇中差异表达的一对一直向同源物计算成对簇相关性。这揭示了ZBTB20 + ETV1 +细胞之间的进一步异质性,其中海龟背内侧皮层簇显示出与小鼠CA3或CA1的最佳相互相关性。
哺乳动物CA3或CA1标记物在这些海龟群中差异表达(图3C)。
CA3-和CA1-样细胞占据相邻的位置(CA3-样细胞最接近中皮层(DG))并形成形态学上不同的细胞板(图3A和图S11)。
显示蜥蜴中泛海马标记ZBTB20、DG标记PROX1、CA标记ETV1和CA3标记COCH表达的原位杂交。
我们没有发现爬行动物CA2细胞类型的证据(图3B和图S11B)。
总之,爬行动物海马体可以被细分为相邻的区域,类似于哺乳动物的DG、CA3和CA1区域。这些细胞发育起源于中央大脑皮层,它们相似的内外侧分布、连接、生物物理特性和分子同一性(本研究)支持这样的假设,即哺乳动物样海马区域已经作为相邻区域存在于所有羊膜动物的祖先中。哺乳动物海体的结构及其标志性的折叠,可能是由于哺乳动物谱系中新皮层的显著扩大造成的。
海龟背皮层新皮层上层和深层的转录组特征
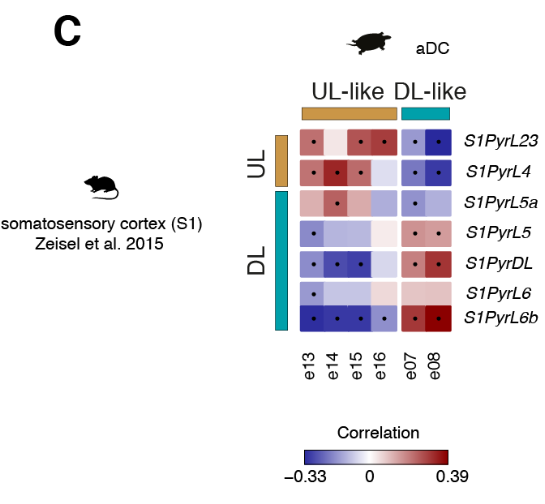
哺乳动物的六层新皮层是从最开始的羊膜动物的的可能存在三层原始皮层进化而来的。哺乳动物新皮层和爬行动物皮层中的神经元和层之间的关系是什么?早期的研究表明,L2/3和L4(较上面的层,UL)神经元是哺乳动物新生的;因此爬行动物的锥体神经元要与哺乳动物早期出生的L5和L6(深层,DL)神经元相比较。但是,连接性意味着爬行动物的皮层应该包含L4(即丘脑受体)和L5(离皮质细胞)两种类型,可以推出这些类型不是占据不同的层,而是占据海龟皮层的相邻区域:一个在前背皮层(RORB+ L4样神经元),一个在后背皮层(ETV1 + L5样神经元)。
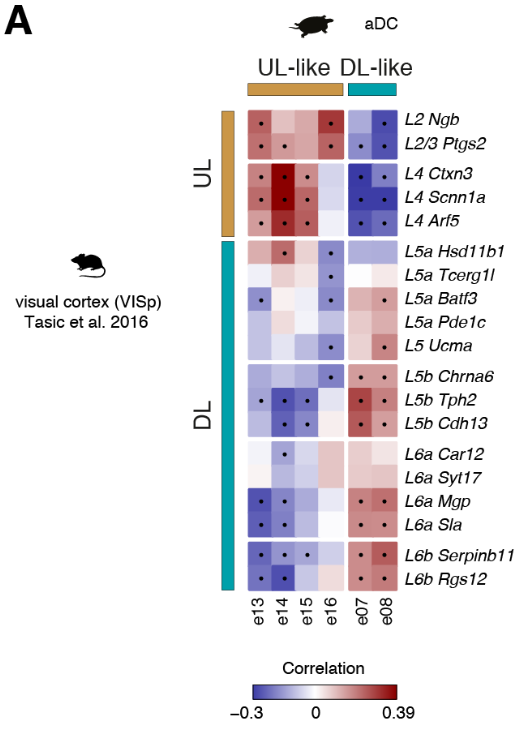
我们的数据表明,前背皮层是唯一可与哺乳动物新皮层相比的区域(图2)。我们检测了原型哺乳动物层标记物(7,25,26)在六个海龟前背皮层谷氨酸能簇(e07,e08,e13至e16)中的表达。
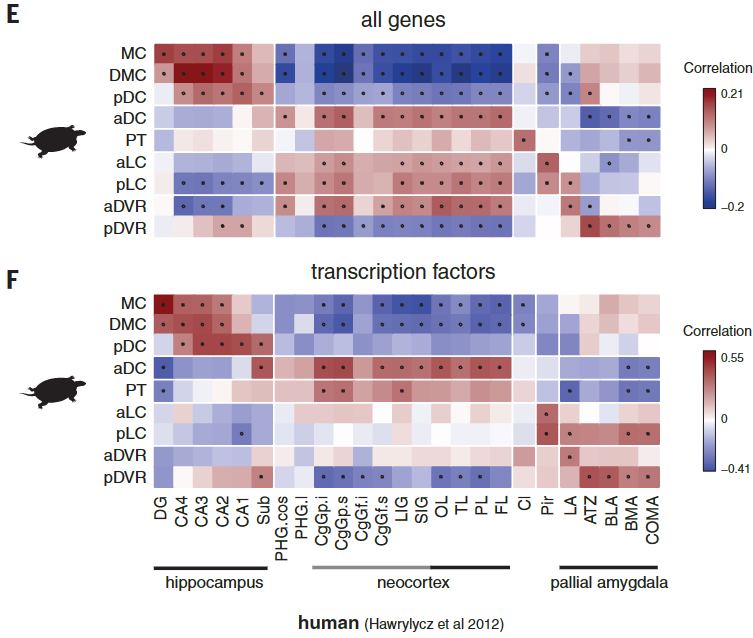
海龟谷氨酸能超簇和人类大脑皮层区域的成对相关性,由海龟或人类中差异表达的所有基因(E)或转录因子(F)计算得出。在哺乳动物中,只有扣带回(CgG)、长岛回(LIG)和短岛回(SIG)的一些部分被归类为新皮层。圆点表示统计上显著的cor关系。MC,内侧皮质;DMC,背内侧皮质;pDC和aDC,后背皮质和前背皮质;PT,大脑皮层增厚;aLC和pLC,前外侧皮质和后外侧皮质;aDVR和pDVR,前、后背侧脑室嵴;DG,齿状回;钙,氨角;亚托,下托;海马旁回;OL,枕叶;TL,颞叶;PL,顶叶;FL,额叶;Cl,claustrumPir,梨状皮质;LA,外侧杏仁核;ATZ,杏仁核-海马过渡带;BLA,基底外侧杏仁核;BMA,基底内侧杏仁核;昏迷,皮质内侧杏仁核。
这些细胞表达了几种哺乳动物UL和DL标记,但是这些基因通常在相同的簇中共表达(图4A和图S13A)。
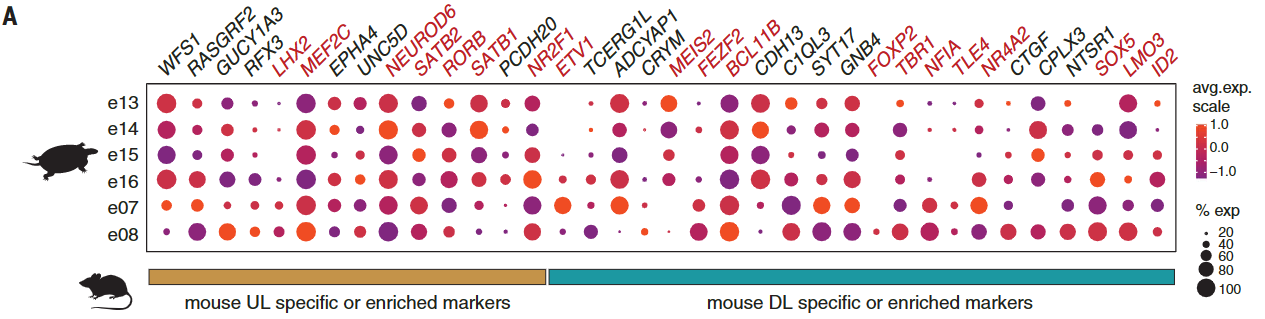
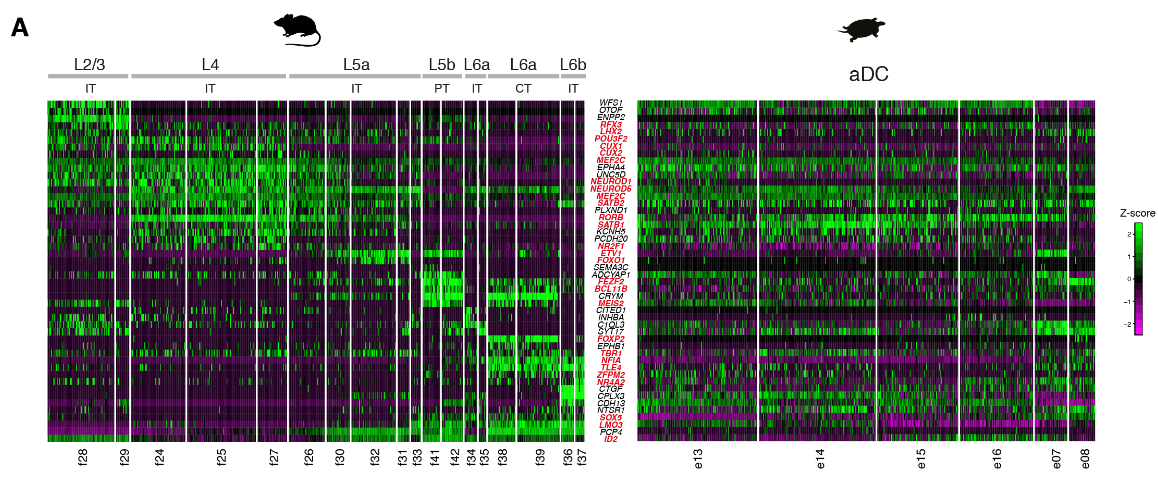
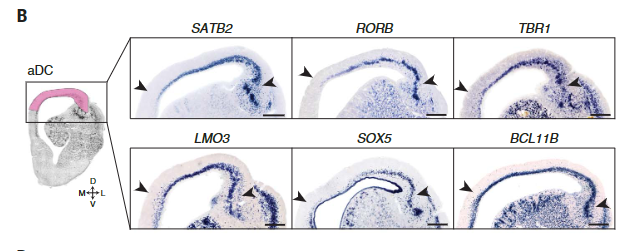
当我们专注于在新皮层中建立和维持细胞身份的转录因子时,我们观察到,在海龟中,这些基因以组合形式表达,且从未在分化的哺乳动物皮质神经元中观察到。例如,所有海龟前背皮质细胞类型共表达富含哺乳动物L2/3、L4和L5a的大脑内神经元的基因,包括SATB2、RORB和RFX3,以及指定L5b和L6离皮质投射神经元的基因,如BCL11B (CTIP2)、TBR1和SOX5(除e13外的所有簇)(25)(图4,A和B)。
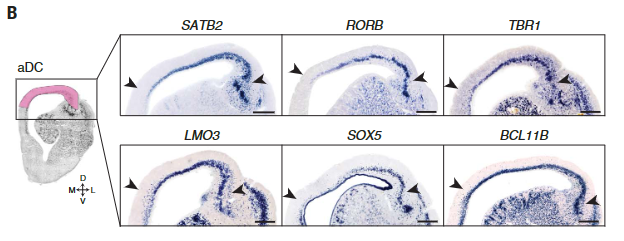
在小鼠新皮层中,已知这些基因中的一些在有丝分裂后细胞中抑制彼此的表达(例如,Satb2和Bcl11bTbr1和Bcl11b) ( 26)
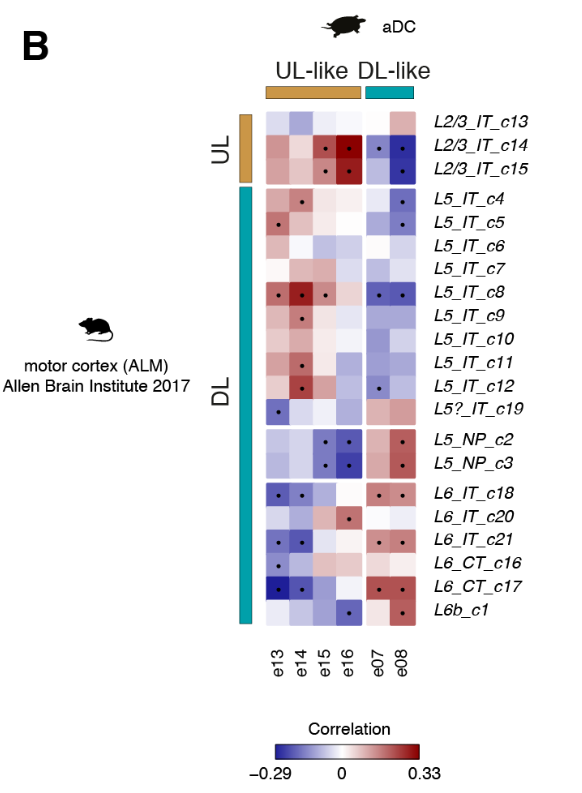
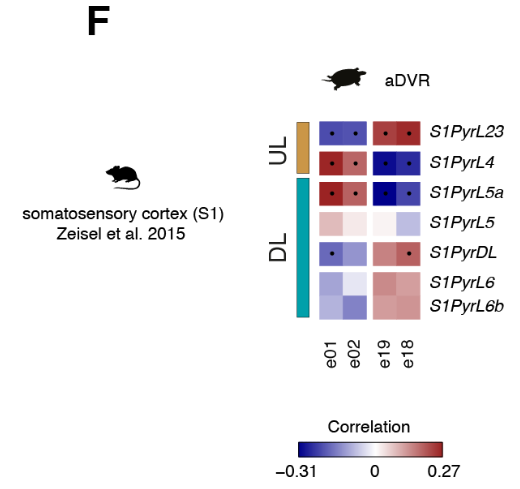
将比较分析扩展到所有差异表达的基因,揭示了前背皮质细胞类型与哺乳动物UL (e13至e16)或DL(e07和e08)神经元相关,独立于用于比较的新皮质区(图4C和图S14,A至C)。
基因网络分析证实了这一趋势(图S13,B和C)。
相比之下,前DVR簇不能被分组为UL类和DL类(图S14,D至F)。


正如测序数据所预期的,原位杂交(ISHs)显示哺乳动物UL和DL转录因子在整个海龟前背皮质中共表达(图4B)。
单个UL样神经元类型(e13至e16)沿前背皮质的内外侧和喙尾轴有差异地分布,与已知的解剖亚类相匹配(图S15)。
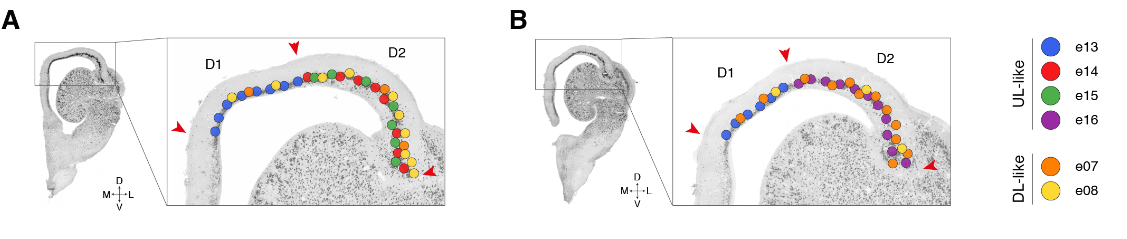
相比之下,通过甲状旁腺激素样激素(PTHLH)表达识别的DL样细胞e07和e08似乎散布在整个前背皮质。在吻侧背侧皮质中,DL样细胞局限于L2的表面部分(图。4D;图S15、C至E中的附加标记)。
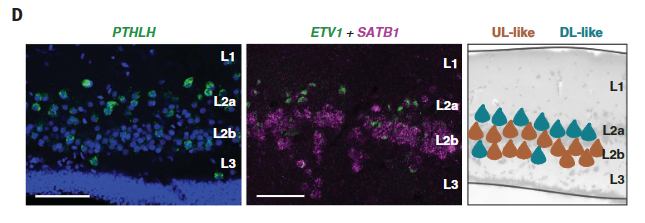
左图,用PTHLH(绿色)标记的龟DL样细胞,优先在浅表L2中发现(蓝色,4ʹ,6-二脒基-2-苯基吲哚(DAPI))。中图,SATB1(富含UL样细胞,品红色)和ETV1 (e07 DL样细胞,绿色)的双ISH,显示了这些细胞的相对位置。右图是总结UL样和DL样谷氨酸能神经元分布的示意图(与在哺乳动物中观察到的排列相反)。
因此,这些标记确定了海龟L2的两个不同亚层:主要含有DL样神经元的表层L2a和主要含有UL样神经元的深层L2b。从丘脑的逆行追踪标记L2a细胞,表明这些神经元或它们的子集是离皮质的并投射到丘脑。
总之,我们的转录组范围的比较揭示了在海龟前背皮层不同的神经元类型中存在整体的UL和DL样的遗传标记,但是在目前的分辨率下,不支持海龟谷氨酸能类型和个体新皮质层之间的同源性。
在爬行动物和哺乳动物中,UL和DL基因特征可能是从缺乏明显的UL和DL样神经元的原始羊膜中独立进化而来的:具有相似特征(如输入输出连接性)的神经元将通过趋同进化获得相似基因组的表达。或者可能是UL样和DL样神经元可能已经存在于羊膜干细胞的背皮质中。如果是真的,形成哺乳动物新大脑皮层的六层的出现将是一个新奇的事物,通过对指定祖先UL和DL样类型的遗传程序的广泛修改,使得新锥体细胞类型的进化。
羊膜动物γ-氨基丁酸能中间神经元的保守性
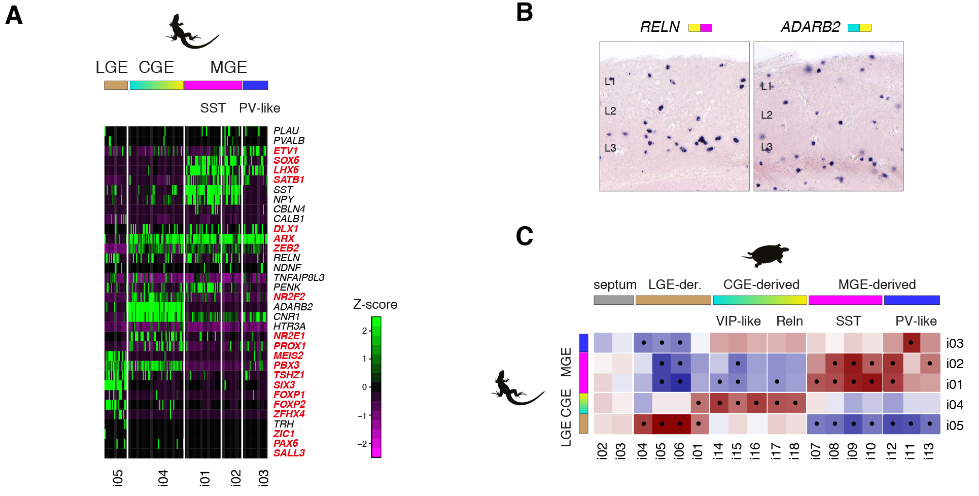
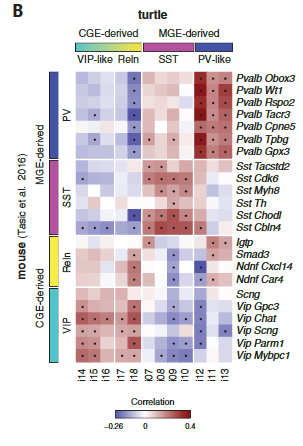
哺乳动物新皮层中的γ-氨基丁酸能中间神经元是多样的,并参与不同的回路基序和计算。但是我们却对哺乳动物以外的皮质中间神经元知之甚少。在包括龟在内的几种脊椎动物中,γ-氨基丁酸能中间神经元在保守的小脑延髓下区域产生——在内侧、尾侧和外侧神经节隆起(MGE、CGE和LGE)——并迁移到大脑皮层。然而,爬行动物被认为缺乏一些哺乳动物γ-氨基丁酸能类型,如皮质血管活性肠肽(VIP)中间神经元。我们研究了海龟γ-氨基丁酸能簇(i01至i18)和已知定义哺乳动物γ-氨基丁酸能类型的转录因子的表达。从这些基因的组合表达中,我们鉴定了推定的MGE衍生的(i07至i13: LHX6+,SOX6+和SATB1+),CGE衍生的(i14至i18: NPAS1+,SP8+,NR2E1+和PROX1+)和LGE衍生的(i01和i04至i06:meis 2+zi C1-和在子集TSHZ1+ SIX3+和/或PBX3+)簇(图5A)。
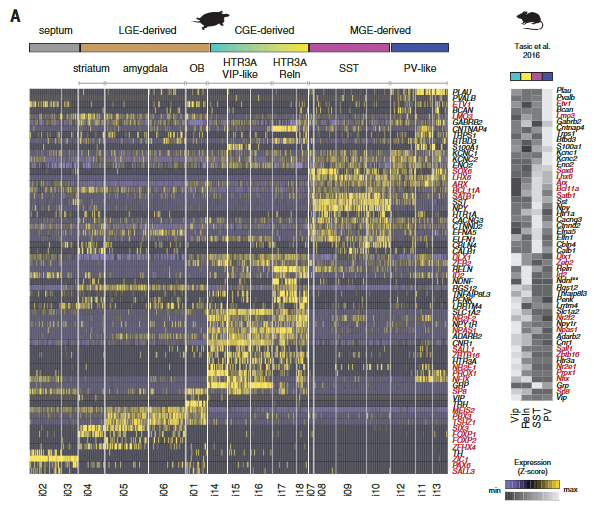
在蜥蜴中也可以鉴定出相应的MGE、CGE和LGE衍生的神经元(图S16,A至C)。
剩余的γ-氨基丁酸能簇对应于从邻近的隔膜(i02和i03)和纹状体(i04)分离的细胞。染色显示在杏仁核(i04和i05)和嗅球(i01和i02)中存在LGE和隔源性中间神经元,表明在爬行动物和哺乳动物中LGE和隔源性γ-氨基丁酸能神经元具有相似的分子特性和迁移轨迹(图5A和图S16,D和E)。
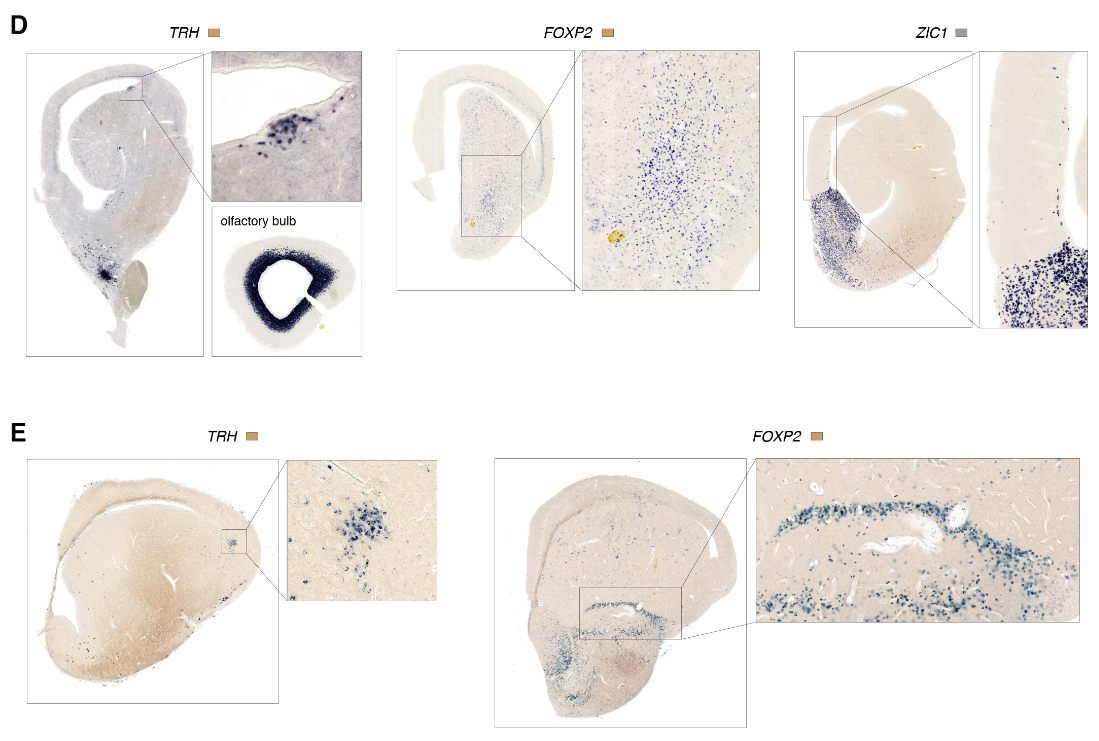
海龟MGE和CGE衍生的中间神经元可以进一步细分为生长抑素(“SST”)、小清蛋白样(“PV样”)、HTR3A Reln和“HTR3A VIP样”类,与哺乳动物皮质γ-氨基丁酸能中间神经元的分类相匹配(7,30)(图5A)。成对聚类相关性(图5B)和基因网络分析(图S17)进一步支持PV-like、SST和HTR3A中间神经元类在爬行动物和哺乳动物中保守的结论。(注意,转录组学鉴定VIP和PV样中间神经元,即使VIP和PVALB在这些细胞中不可靠表达(图5A)。)
在海龟和蜥蜴中,MGE和CGE衍生的中间神经元的标记物在分布于包括背皮层在内的整个大脑皮层的细胞中表达(图5C)。
在哺乳动物中,MGE和CGE衍生的中间神经元在皮质层中具有不同的密度,表达ADARB2 (HTR3A)和SST (SST)的神经元分别优先在浅背皮质和深背皮质中发现;NDNF (HTR3A Reln)在罕见的背侧皮质软膜下细胞中表达,使人想起哺乳动物L1神经胶质细胞(图5,D和E)。
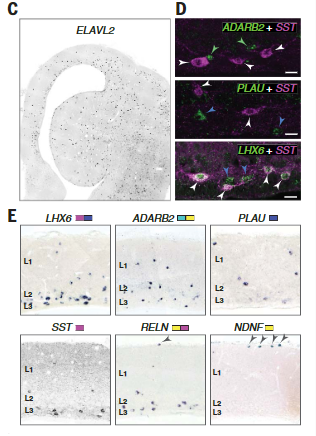
因为在哺乳动物和爬行动物中存在相同种类的皮质γ-氨基丁酸能神经元,它们可能存在于它们的羊膜祖先中。我们的分析没有在更精细的水平上发现相似性:例如,我们没有发现与哺乳动物Martinotti或篮子细胞相对应的海龟群。这表明,在哺乳动物和爬行动物中,中间神经元的物种特异性亚型独立地从祖先的PV样、SST和HTR3A(可能是VIP样和Reln)细胞类别中分化出来。
讨论
我们的单细胞数据为羊膜上皮中保守区域和细胞类型的存在提供了分子支持。哺乳动物新大脑皮层、“核心”海马(具有齿状和CA区域)、皮层和大脑皮层杏仁核的同源物可能已经存在于干细胞羊膜动物中。具有UL或DL样遗传标记的谷氨酸能神经元存在于海龟前背皮层中,但是我们的数据不支持这些细胞类型和单个哺乳动物层类型的一对一同源性。相反,皮质γ-氨基丁酸能中间神经元类(SST、PV样和HTR3A)是羊膜动物的祖先。
我们的分析表明,哺乳动物和爬行动物的大脑通过不同大脑皮层区域的扩展和独立进化而多样化,并且这些扩展与新神经元类型的进化相一致。例如,大型爬行动物的前DVR(腹侧大脑皮层)由专门处理视觉、听觉或躯体感觉刺激的空间分离的神经元类型组成。同样的感觉通路也到达哺乳动物的腹侧大脑皮层(例如,外侧杏仁核),但不被那里的专用神经元群处理。这表明DVR神经元和回路的形成是爬行动物和鸟类特有的。
背侧大脑皮层的情况正好相反。哺乳动物的新皮层是通过一个小的背侧皮层区域的扩张而出现的,与爬行动物的前背侧皮层和鸟类的前背侧皮层同源。这可能与UL样和DL样神经元的多样化产生新的谷氨酸能细胞类型相一致。具有不同身份的神经元的连续产生是哺乳动物和爬行动物背侧大脑皮层祖细胞的保守特征,并且皮质丘脑神经元是小鼠和海龟中早期出生的神经元。
海龟和哺乳动物的神经元出生顺序是相同的(DL在先,UL在后),海龟DL样神经元的表面位置与皮质发生的反转一致(爬行动物由外向内,哺乳动物由内向外)。最后,在哺乳动物中,决定UL和DL命运的转录因子在祖细胞中共表达,并且只有在细胞周期结束后才获得相互排斥的表达。哺乳动物UL和DL命运说明符在海龟神经元中的共表达表明,皮质层可能是从这些转录因子之间的调节相互作用的重塑中进化而来的,可能是通过新的抑制相互作用。神经发生的时间延伸可能使最初重叠的基因表达程序分离,从而使祖先UL和DL类型多样化。
这些海龟和蜥蜴大脑皮层的分子图谱为未来的功能研究提供了一个框架。基因表达程序的异同如何告知我们大脑功能的进化?例如,爬行动物皮层的大部分在分子上与核心哺乳动物海马体相关。爬行动物的损伤实验表明内侧皮质在导航中的作用,但目前还没有从这些区域获得慢性电生理数据。需要将我们的分子图谱与示踪、电子显微镜和电生理学研究相结合,以了解基因表达程序是否以及如何与连通性和功能的进化相关联。
突触组织的一般原理可以从三层和六层皮层的比较中推断出来。这些相似之处是巧合还是反映了祖先的皮层回路?在哺乳动物中,局部回路基序涉及具有不同分子和功能特征的γ-氨基丁酸能类型。我们的研究表明,中间神经元的多样性是哺乳动物和爬行动物的祖先。中间神经元类在至少3.2亿年间的保守性表明,不仅存在中间神经元多样性的选择压力,而且中间神经元多样性本身可能在原始皮质回路内的干细胞脊椎动物中进化而来。或者,中间神经元类的保守性可能仅仅是由于球下模式的发育限制。对爬行动物大脑皮层中回路基序的分子和功能的联合研究可能有助于理解脊椎动物大脑皮层的祖先设计和计算逻辑。
